1.原理
BCA检测法是Lowry测定法的一种改进方法。与Lowry方法相比,BCA法的操作更简单,试剂更加稳定,几乎没有干扰物质的影响,灵敏度更高(微量检测可达到0.5μg/ml),应用更加灵活。
蛋白质分子中的肽键在碱性条件下能与Cu2+络合生成络合物,同时将Cu2+还原成Cu+。二喹啉甲酸及其钠盐是一种溶于水的化合物,在碱性条件下,可以和Cu+结合生成深紫色的化合物,这种稳定的化合物在562nm处具有强吸收值,并且化合物颜色的深浅与蛋白质的浓度成正比。故可用比色的方法确定蛋白质的含量。
2.测定意义
样品可溶性蛋白质含量常常用于酶活性计算。此外,可溶性蛋白质含量也用于食品等质量分析。
3.测试所需仪器设备及自备试剂
可见光分光光度计(562nm),恒温水浴锅,离心机, 漩涡混匀器,精密移液器,试管。
4.适用范围
本试剂盒可测定动物血清(浆)、组织等样本的总蛋白含量。
5.试剂及配置
试剂 | 100T |
标准品(0.563mg/ml) | 1ml*1瓶,4℃保存。 |
试剂A | 25ml*1瓶,4℃保存。 |
试剂B | 1ml*1支,4℃保存。 |
BCA工作液的配置:将1ml试剂B完全倒入试剂A瓶中,充分混匀,即为BCA工作液。
6.样本处理
(1)组织:按照组织质量(g):PBS体积(mL)为1:9的比例(建议称取约0.1g组织,加入0.9mL PBS)进行冰浴匀浆,8000g 4℃离心10min,取上清液待测。
(2)血清等液体:建议血清(浆):PBS=1:49进行稀释。
(3)其他液体样品:按比例稀释,测定范围为20-2000μg/ml,(不同的样本稀释度不一样),请在批量测试前先做1-2个样本的预实验
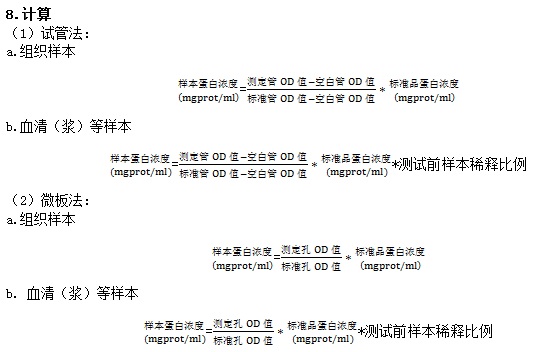
7.操作步骤
(1)试管法:
试剂(ml) | 空白管 | 标准管 | 测试管 |
双蒸水 | 0.1 |
|
|
0.563mg/ml |
| 0.1 |
|
待测样本 |
|
| 0.1 |
BCA工作液 | 2 | 2 | 2 |
漩涡混匀,37℃孵育30min,然后冷却至室温,于562nm处,1cm光径,蒸馏水调零,测定各管吸光值(10min内测完)
(2)微板法:
试剂(μl) | 空白孔 | 标准孔 | 测试孔 |
双蒸水 | 25 |
|
|
0.563mg/ml |
| 25 |
|
待测样本 |
|
| 25 |
BCA工作液 | 200 | 200 | 200 |
轻轻摇晃混匀,37℃孵育30min,然后冷却至室温,酶标仪562nm,空白孔调零,测定各孔吸光值(10min内测完)
(1).在低温条件或长期保存出现沉淀时,可搅拌或37℃温育或微波几十秒使溶解,如发现细菌污染,则应丢弃。
(2)样品中若含有EDTA、EGTA、DTT、硫酸铵、脂类会影响检测结果,请试用Bradford蛋白浓度测定试剂盒;高浓度的去垢剂也影响实验结果,可用TCA沉淀去除干扰物质。
(3)要得到更为精确的蛋白浓度结果,每个蛋白梯度和样品均需做复孔且标准品与样品处理要尽量一样(如采用同样的溶液溶解样品和标准品),每次均应做标准曲线。4.当试剂A和B混合时可能会有浑浊,但混匀后就会消失。
(4)当试剂A和B混合时可能会有浑浊,但混匀后就会消失。
(5)需准备37℃水浴或温箱、酶标仪或普通分光光度计,测定波长为540-595nm之间,562nm最佳。酶标仪需与96孔酶标板配套使用。使用分光光度计测定蛋白浓度时,试剂盒测定的样品数量会因此而减少。使用温箱孵育时,应注意防止因水分蒸发影响检测结果。